INJECTIONS DE FACTEURS DE CROISSANCE PRP THÉRAPIE PAR
MAGNOVISION THÉRAPIE
PAR
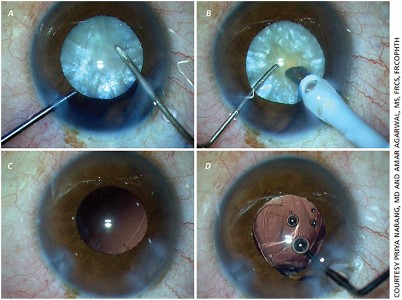
PHOTOBIOMODULATION OPÉRATION DE PROTHÈSE RÉTINIENNE ARGUS II
Le globe oculaire est constitué de paramètres de réfraction qui concentrent la lumière sur la rétine d’avant en arrière. La cornée est à l’avant et la lentille derrière focalise la lumière sur la rétine.
Le globe oculaire se compose de 3 couches de l’intérieur vers l’extérieur. La rétine la plus interne est la couche vasculaire au milieu et la plus externe est le blanc de l’œil qui donne au globe oculaire sa rigidité.
Les objets peuvent être vus lorsque les rayons provenant des objets se concentrent sur la rétine. Il y a des cellules dans la rétine qui convertissent l’énergie lumineuse en énergie électrique et la transmettent au cerveau. Ceux-ci sont appelés photorécepteurs. Les photorécepteurs se composent de deux groupes :
- Cellules coniques : images formées au centre et dans un environnement lumineux,
- Cellules en bâtonnets : traite les images formées dans l’environnement environnant et sombre.
En d’autres termes, ils convertissent les rayons provenant des objets en énergie électrique.
Vue au microscope électronique de la section prélevée sur la rétine. Juste au-dessus de l’épithélium pigmentaire le plus bas se trouvent des cellules photoréceptrices constituées de bâtonnets et de cônes.
La rétinite pigmentaire commence par une mutation, ou un défaut, dans les gènes des cellules photoréceptrices.
250 mutations génétiques différentes conduisent à 50 types différents de cette maladie. Pour cette raison, les symptômes cliniques et le taux de progression sont différents chez chaque patient. Il est généralement familial en raison d’un mariage consanguin, mais il peut également survenir en dehors de la famille.
La mutation génétique entraîne un vieillissement prématuré et la mort progressive des cellules photoréceptrices. Avec l’âge, la mort cellulaire s’accélère.
Les facteurs de croissance permettent la conversion du glucose dans le sang en ATP-GTP, qui est le carburant des cellules. En l’absence de facteurs de croissance, les cellules photoréceptrices ralentissent leurs activités métaboliques par manque d’énergie, passent en mode sommeil et si le processus se poursuit, la mort cellulaire se produit progressivement.
Les facteurs de croissance qui maintiennent les photorécepteurs en vie ne sont pas sécrétés par l’épithélium pigmentaire et les cellules de Müller, qui présentent des caractéristiques de cellules souches. Les photorécepteurs passent longtemps en mode veille avant de mourir lentement. A ce stade, les cellules sont vivantes mais ne participent pas à la fonction de vision.
Quelles cellules entrent en mode veille ou meurent en premier, les symptômes commencent en conséquence. Par exemple, si les cellules en bâtonnets commencent à mourir en premier, le premier symptôme sera une vision nocturne réduite.
Dans certains types génétiques de la maladie, les cellules coniques sont affectées avant que les cellules bâtonnets ne le soient. Les cellules coniques passent d’abord en mode veille puis meurent.
Cette condition est observée dans la maladie de stargarth, la rp inversée ou la dystrophie des cônes.
Ici, le premier symptôme est un éblouissement excessif de la lumière et une meilleure vision dans les environnements sombres et la nuit. Au fur et à mesure que la maladie progresse, la vision centrale est perdue et la vision périphérique est préservée.
Traitement de la rétinite pigmentaire :
1) Cellules Souches et Thérapie Génique :
Ses études sont toujours en cours et le groupe cible est le groupe de patients qui n’ont pas complètement perdu la vue et qui ont des cellules vivantes en mode sommeil. La logique de la thérapie par cellules souches est d’injecter des cellules capables de sécréter du facteur de croissance entre 6 mois et 2 ans, dans ou autour de l’œil, et de répéter ce processus tous les 6 mois ou 2 ans.
En thérapie génique, le gène défectueux dans les photorécepteurs qui n’ont pas perdu leur vitalité est détecté, le gène corrigé est chargé dans des virus et injecté dans l’œil. L’objectif est à nouveau d’arrêter la mort des photorécepteurs vivants.
2) Diagnostic précoce :
Plus le diagnostic est posé tôt, plus la mort des cellules restantes peut être ralentie au maximum sans perte supplémentaire de photorécepteurs, stoppée, voire réveillée.
3) Injections de facteur de croissance
Ngf, bdnf, bfgf, IL6 sont des facteurs de croissance nécessaires aux photorécepteurs pour maintenir leur vitalité et leurs fonctions.
Une première mise en charge puis une réinjection à certains intervalles peuvent ralentir ou arrêter l’évolution de la maladie. Dans certains cas, selon la présence ou le nombre de cellules en mode veille, l’élargissement du champ visuel et l’acuité visuelle peuvent être augmentés.
Agrandissement du champ visuel après la 3e injection
4) Okuvision & Magnovision
La stimulation électromagnétique de la rétine et du centre visuel dans le cerveau augmente non seulement la sécrétion des facteurs de croissance nécessaires dans le système nerveux, mais permet également la formation de nouvelles voies visuelles appelées plasticité neuronale et la réorganisation de la fonction visuelle.
Le réveil des photorécepteurs en mode sommeil et l’élargissement du champ visuel chez le patient qui a subi une injection de facteur de croissance en même temps que la magnovision sont illustrés dans la figure ci-dessous.
5) Traitement des complications
La cataracte se développe fréquemment chez les patients rp. Aux stades avancés, les vaisseaux rétiniens s’amincissent et l’oxygène atteignant les tissus intraoculaires et les nutriments essentiels diminue. Cela accélère le développement des cataractes.
L’opération de la cataracte chez les patients rp peut accélérer la mort cellulaire dans la rétine et provoquer une augmentation excessive de l’œdème maculaire. Pour cette raison, protéger la rétine avec des facteurs de croissance avant l’opération de la cataracte minimisera les risques possibles.
L’œdème maculaire est une autre complication fréquente chez les patients atteints de rp. L’œdème à un certain niveau ne nécessite pas de traitement car il répond à l’exigence de facteur de croissance pour les photorécepteurs. Cependant, l’œdème qui altère l’acuité visuelle et devient cystoïde nécessite un traitement. S’il ne peut pas être contrôlé avec des gouttes ophtalmiques, l’œdème doit être contrôlé par des injections intraoculaires.
6) Lunettes de sécurité
Le filtrage de la lumière bleu-violet à une longueur d’onde de 415-455 nm réduit le taux de mortalité des photorécepteurs de 25 %. Il est particulièrement recommandé aux utilisateurs d’ordinateurs.
Les lentilles orange 500 nm sont recommandées pour les patients rp présentant une cataracte initiale ou un éblouissement excessif à la lumière où les cellules coniques sont également affectées.
7) Outils de rééducation basse vision :
Chez les patients dont les cellules coniques sont atteintes et dont la vision périphérique est bonne, les lunettes télescopiques, les loupes avec éclairage ou les loupes avec caméras CCTV répondent particulièrement bien aux besoins de lecture des patients.
8) Implantation de lentilles télescopiques intraoculaires :
Les lentilles intraoculaires télescopiques prismatiques, qui déplacent l’image hors de la zone morte, donnent des résultats satisfaisants chez les patients appropriés chez les patients dont les cellules coniques sont atteintes et dont la vision périphérique est bonne.
9) Nutrition-vie saine :
Il est possible de ralentir le taux de mortalité des photorécepteurs en consommant des aliments riches en vitamines et minéraux antioxydants et des compléments alimentaires. L’acide B12-b6-b1-folique et les oméga-3 sont notamment nécessaires aux activités vitales des cellules neuronales, tandis que la vitamine a-lutéine-carotène est nécessaire à la synthèse des pigments nécessaires à la fonction visuelle des photorécepteurs.
Nutrition de type méditerranéen
- Saumon grillé : 2 jours par semaine (tous les poissons gras – à condition qu’ils soient grillés ou cuits au four) – (le poisson frit n’a aucun avantage.)
- Beaucoup de salade verte + carottes râpées
- Œufs à la coque : 3 jours par semaine (œufs à la coque à la consistance d’abricot)
- Raisins secs à pépins noirs ou raisins noirs frais en saison : une fois par semaine, une poignée
- Amandes crues : une fois par semaine, une poignée
- Noix : une fois par semaine, une poignée
- Kéfir : 2 jours par semaine, 1 verre
30 minutes de marche à l’extérieur chaque jour
Absolument non fumeur
Abstinence d’alcool
Cela ralentira considérablement le taux de mortalité des photorécepteurs.
10) Pour les patients dont les photorécepteurs ont complètement perdu leur vitalité :
Vision virtuelle et rééducation avec des puces pour remplir la fonction de photorécepteurs.
L’image est perçue par une caméra – convertie en énergie électrique et transmise au cerveau par des électrodes. Pour ça,
- brainport v200
- argus 2 yeux bioniques
- prothèse corticale
La méthode la plus appropriée est appliquée au patient approprié.